 |
 |
 |
Ubiquinona
Ubiquinol
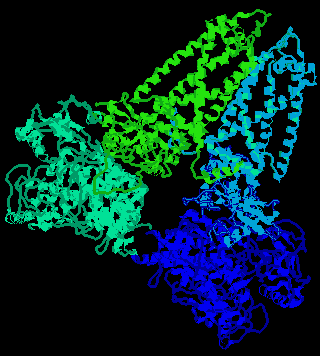
É centrada numa flavoproteína (FAD) contendo ferro-enxofre. O complexo, presente na mitocôndria, pode ser degradado para formar EC 1.3.99.1, que não detém mais a capacidade de ligar-se à ubiquinona.
Em bactérias, dois distintos complexos enzimáticos ligados à membrana são responsáveis pela interconversão de fumarato e succinato (EC 1.3.99.1): fumarato redutase é utilizada durante o crescimento anaeróbico, e succinato desidrogenase durante o crescimento aeróbico. Ambos consistem de dois componentes principais: um componente extrínsico à membrana composto de uma flavoproteína que liga-se a FAD e uma proteína ferro-sulfúrica; e um componente hidrofóbico composto de uma proteína ancorada à membrana e/ou um citocromo B.
Em eucariontes a succinato desidrogenase mitocondrial (EC 1.3.5.1) é uma enzima composta de duas subunidades: uma FAD-flavoproteína e uma proteína ferro-sulfúrica.
A subunidade flavoproteína
é uma proteínade 60 a 70KDa. O FAD está covalentemente
ligado a um resíduo de histidina localizado na porção
N-terminal da proteína. A seqüência ao redor desta histidina
é bem conservada de bactérias a espécies eucarióticas,
e pode ser utilizada para reconhecimento.
Referência